خلايا سرطان الثدي، ربما تكون عرضة لتأثير العقاقير المتنكرة في صورة أجسام مضادة؛ لتفادي أنظمة الدفاع.
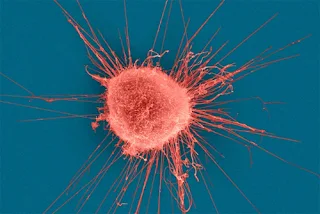 |
| خلايا سرطان الثدي، ربما تكون عرضة لتأثير العقاقير المتنكرة في صورة أجسام مضادة؛ لتفادي أنظمة الدفاع. Dennis Kunkel Microscopy/SPL |
صُمِّم الجيل القادم من الأدوية الشبيهة بـ"حصان طروادة" للتقليل من الضرر الذي يلحق بالخلايا السليمة.
بعد عقود من الإحباط، بدأت الجهود المبذولة لتطوير أجسام مضادة تستطيع نقل الأدوية إلى الخلايا السرطانية، وتقليل الأضرار التي تلحق بالأنسجة السليمة، في التقدم بسرعة متزايدة. وبالفعل، فإن الجيل القادم من العلاجات بهذه "الأجسام المضادة المسلحة"، التي يُطلق عليها "دواء وجسم مضاد متقارن"، (أو مركّبات ADCs، اختصارًا)، يشق طريقه الآن من خلال التجارب الإكلينيكية.
وقد اجتمع باحثون - في يوم 30 من شهر نوفمبر الماضي - لمناقشة هذه النهضة العلمية، في ندوة حول الأهداف الجزيئية وعلاجات السرطان في ميونخ في ألمانيا. وتأتي التحسينات التي حدثت بعد أن فشلت الموجة الأولى من مركّبات ADCs التجريبية في تحقيق الآمال التي كانت قد وُضعت عليها.
"في البداية، أثار الأمر كثيرًا من التشويق، ثم اتضح ببطء أن مركّبات كثيرة - في الواقع - لا تعمل"، كما يقول رافيت حسن، وهو باحث في مجال السرطان في المعهد الوطني للسرطان في مدينة بيثيسدا بولاية ميريلاند. كما أضاف أن هناك الآن نوعين جديدين من مركّبات ADCs في المرحلة الثالثة من التجارب الإكلينيكية، وغيرهما الكثير في مراحل مبكرة عن ذلك.
المبدأ الذي تقوم عليه هذه الأدوية مبدأ بسيط، يتلخص في تطويع جسم مضاد لغرض مختلف، وتحويله إلى أداة تنقل دواء سامًّا إلى داخل خلية سرطانية. وفَوْرَ أن يجد الجسم المضاد الموجود في مركّب ADC خلية وَرَمِيَّة ويرسى عليها؛ تمتصه الخلية، وتكسر الروابط الجزيئية التي تربط الدواء بالجسم المضاد؛ فيتحرر الدواء من أجل قتل الخلية من الداخل، إلا أن هذا النهج ثبت أنه صعب التحقيق. ففي بعض الأحيان تكون الروابط الجزيئية قوية جدًّا، وبالتالي فهي لا تُطْلِق الدواء داخل الخلية. وفي أحيان أخرى، تكون غير مستقرة بشكل كبير، فتُطْلِق الدواء قرب الخلايا السليمة؛ ما يحدّ من جرعة الدواء التي يمكن تناولها. وحتى الأدوية نفسها قد تشكِّل مشكلة، فحيث إن معظمها سام للخلايا سريعة الانقسام في الأساس، فقد تتجاهل الخلايا بطيئة الانقسام، التي تشكل بذور الأساس لإنشاء بعض الأورام. وكان بعضها قد واجه صعوبة في اختراق بضع طبقات من الخلايا في الأورام المستهدفة.
يقول حسن إن الباحثين يتتبعون مركّبات ADCs منذ عقود، وقد وافقت إدارة الغذاء والدواء الأمريكية على ثلاثة منها، إلا أن واحدًا قد تم سحبه من الأسواق فيما بعد، وسط مخاوف من كونه ليس فعالًا، وأنه يحمل مخاطر تتعلق بالسلامة. أما الاثنان الآخران، فقد كان مصيرهما أفضل.. فمبيعات عقار "أدسيتريس" Adcetris (المكون من مركّب برنتوكسيماب فيدوتين brentuximab vedotin )، الذي تم اعتماده في عام 2011 لعلاج سرطان الغدد الليمفاوية، وعقار "كادسيلا" Kadcyla (المكون من تراستوزوماب امتانسين trastuzumab emtansine )، المعتمد في عام 2013 لعلاج سرطان الثدي، بدت مشجِّعة، كما يقول ريان مليون، رئيس مكتب سان فرانسيسكو لشركة الخدمات الاستشارية لعلوم الحياة والرعاية الصحية "ترينيتي بارتنرز" Trinity Partners.
منحت الموافقات المستثمرين ثقة في المجال، وأدخلت الباحثين في نوبة عمل جنونية؛ لتحسين تصميماتهم. ويخضع أكثر من 40 من مركّبات ADCs حاليًّا للتجارب الإكلينيكية. وفي الوقت الحالي، تُجْرِي شركة "جينينتيك" Genentech – المتخصصة في التكنولوجيا الحيوية في جنوب سان فرانسيسكو بولاية كاليفورنيا، وابتكرت عقار "كادسيلا" - تجارب باستخدام أدوية بديلة، ورابطات جزيئية. يقول برنارد فاين، مدير مجموعة طبية في الشركة: "أصبحت الجهود الكيميائية أكثر تعقيدًا، لاتخاذ القرارات حول أيٍّ من الروابط سيناسب كل عقار". وتعمل الشركة حاليًّا على تسعة من مركّبات ADCs.
يقول ستيفان ديبل - المدير الطبي لبرنامج العلاج المناعي للسرطان في مركز ليون بيرار في ليون في فرنسا - إن الباحثين ينقِّبون أيضًا في مجموعة غنية من البيانات الخاصة بمشروعات وضع تسلسلات السرطان، بحثًا عن أهداف جديدة؛ لتعلق بها الأجسام المضادة". ويضيف قائلًا إن تحديد الأهداف المميزة الخاصة بالخلايا السرطانية فقط، أو نحو ذلك، كان تحديًا كبيرًا، لكن الاهتمام المتزايد بتسخير الجهاز المناعي قاد الباحثين إلى فهرسة بروتينات فريدة، يتم التعبير عنها على أسطح الخلايا الخبيثة.
وتحاول شركات عديدة أن تصوِّب نحو أهداف مألوفة، وذلك باستخدام تصميمات جديدة تمامًا. فقد قامت شركة "ميرسانا ثيرابيوتكس" Mersana Therapeutics - المتخصصة في التكنولوجيا الحيوية - في كمبريدج في ماساتشوستس بربط جسم مضاد ونوع من العقاقير ببوليمر قابل للتحلل الحيوي، بدلًا من ربطهما ببعضهما. وقد سمح ذلك بربط 15 جزيئًا من العقار بكل بوليمر، بدلاً من ثلاثة أو أربعة، كما هو معتاد، كما يقول كبير المسؤولين العلميين تيموثي لووينجر. وتَختبِر شركة "ميرسانا" نهجها في التجارب الإكلينيكية المبكرة؛ لمقارن دوائي يستهدف بروتين HER2، ويتم التعبير عنه بمستويات عالية في بعض أورام سرطان الثدي. يستهدف عقار "كادسيلا" هذا البروتين أيضًا، إلا أن لووينجر يقول إن نسخة شركة "ميرسانا" بإمكانها أن تجلب مزيدًا من الأدوية لكل هدف؛ لتصبح مفيدة في مكافحة السرطانات التي تُظْهِر مستويات منخفضة من بروتين HER2.
وفي شركة "تارفيدا ثيرابيوتكس" Tarveda Therapeutics - المتخصصة في التكنولوجيا الحيوية - في ووترتاون بولاية ماساتشوستس، استغنى الباحثون عن الجسم المضاد بالكامل، واستعاضوا عنه بشريط قصير من الأحماض الأمينية – وهي المكونات الأساسية لبناء البروتينات - لاستهداف الخلايا السرطانية. وكانت النتيجة دواء أصغر حجمًا بحوالي 15 مرة، مِن المرجح أن يخترق الورم بشكل أكثر عمقًا، كما يقول ريتشارد ووستر، رئيس البحث والتطوير بالشركة.
ورغم كل هذا النشاط، فإن التكنولوجيا لم تبلغ ذروتها، كما يقول مليون، "فما زال هناك الكثير من الابتكارات المنتظرة، لكنها عندما تعمل بالفعل، أعتقد أنها ستعمل بقوة".